研究概要
I.シナプスを介した情報のやりとりの重要さ
II. シナプスを研究するには
III. イメージングによって明らかになったシナプスの性質
III-1.発達過程においてシナプスは形成と除去を急速に繰り返す
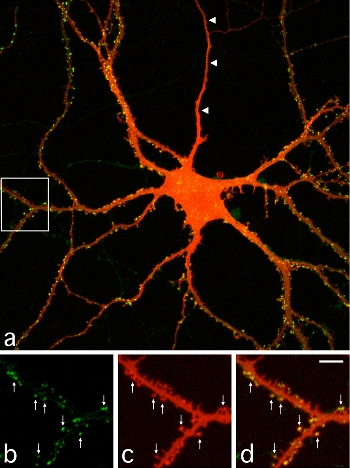
(図1説明)
蛍光蛋白質(GFP)とPSD-95の融合蛋白質を発現した培養海馬神経細胞。細胞内のPSD-95-GFPの分布を緑色で、細胞形態を蛍光色素のDiI(赤)で示す。b, c, dはaの白四角内の拡大像。矢印はPSD-95の集積するスパイン構造を示す。
Okabe, S., Kim, H., Miwa, A., Kuriu, T., and H. Okado. Continual remodeling of postsynaptic density and its regulation by synaptic activity. Nature Neuroscience, 2, 804-811, 1999.
Okabe, S., Miwa, A., and H. Okado. Spine formation and correlated assembly of presynaptic and postsynaptic molecules. Journal of Neuroscience, 21, 6105-6114, 2001.
Ebihara, T., Kawabata, I., Usui, S., Sobue, K., and S. Okabe. Synchronized formation and remodeling of postsynaptic densities: long-term visualization of hippocampal neurons expressing postsynaptic density proteins tagged with GFP. Journal of Neuroscience, 23, 2170-2181, 2003.
III-2. シナプス分子は密に詰まっているがその動態は大きい
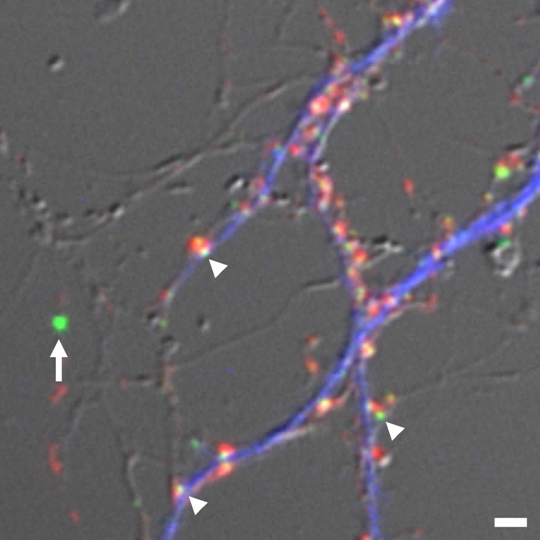
(図2説明)
GFP融合PSD蛋白質の絶対数の推定。GFP1分子でその蛍光強度をcalibrateした蛍光ビーズ(矢印)に対して、PSD-95-GFPを集積する単一シナプス(矢頭)の蛍光強度の相対値を求めることで、単一シナプスに存在するPSD-95-GFP分子の絶対数を推定することが出来る。シナプス前部(赤)と樹状突起(青)も免疫染色によって同定している。
Sugiyama, Y., Kawabata, I., Sobue, K., and S. Okabe Determination of absolute protein numbers in single synapses by a GFP-based calibration technique. Nature Methods 2, 677-684, 2005.
Okabe, S., Urushido, T., Konno, D., Okado, H., and K. Sobue. Rapid redistribution of the postsynaptic density protein PSD-Zip45 (Homer 1c) and its differential regulation by NMDA receptors and calcium channels. Journal of Neuroscience, 21,9561-9571, 2001.
Kuriu, T., Inoue, A., Bito, H., Sobue, K., and S. Okabe Differential control of postsynaptic density scaffolds via actin-dependent and independent mechanisms. Journal of Neuroscience 26, 7693-7706, 2006.
III-3. シナプス形成にはグリア細胞の補助が必要である
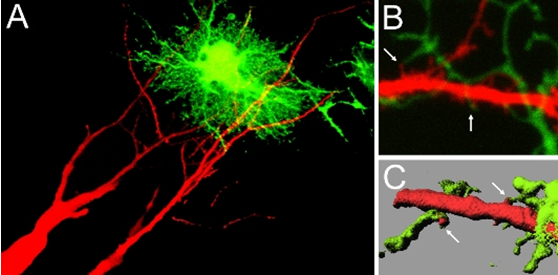
(図3説明)
アストログリアと樹状突起スパインの接触。Aに示すように海馬の錐体細胞に色素(赤)を導入し、アストログリア細胞にGFP(緑)を発現させて、両者が接触する部位を同定している。Bは二光子顕微鏡による光学的断層面を示す。矢印はスパイン(赤)とアストログリアの突起(緑)の接触部位を示す。Cはsurface renderingによって二光子画像から再構築した樹状突起(赤)およびアストログリア(緑)の立体構造。矢印は両者の接する部位を示す。
Nishida, H. and S. Okabe Direct astrocytic contacts regulate local maturation of dendritic spines. Journal of Neuroscience 27, 331-340, 2007.
III-4. シナプス形成の過程は多様である
また小脳のプルキンエ細胞と顆粒細胞の軸索(平行線維)との間に形成されるシナプスでは、平行線維がプルキンエ細胞のスパインと接触した場所から、cbln1分子依存的に微小な突起が形成され、この突起がスパインを包囲する構造を形成してシナプスを成熟させることがわかりました。軸索自身の放出するシナプス誘導因子が軸索の構造変化も誘導する興味深い例と言うことができます。
海馬や大脳皮質の錐体細胞のスパインシナプスに関しても、これまでには知られていなかった新しいシナプス制御メカニズムが解明されつつあります。微小管結合蛋白質であるDCLK1は、非常に強い微小管の重合促進作用と安定化作用を持ち、発達早期には樹状突起の先端に集積します。このために樹状突起先端では微小管依存的な突起伸長の促進が起こるのですが、一方でDCLK1はスパインシナプスの形成を阻害することがわかりました。すなわちDCLK1は樹状突起の成長促進とシナプス成熟の抑制、という二つの機能を樹状突起先端で発揮して両者のバランスを制御する重要な役割を果たします。
小脳のプルキンエ細胞と平行線維の間で働くcbln1分子はシナプス形成を正に制御しますが、シナプス前部から放出されてシナプス形成を負に制御する分子も存在する可能性があります。培養海馬神経細胞においてこのような役割を持つ分子をスクリーニングした結果、軸索から放出されるBMP4分子が軸索膜上のBMP受容体に作用してシナプス除去を促進することを見出しました。神経回路発達過程でBMP4は余分なシナプスの形成を抑制してシナプス密度を適正な範囲に維持する役割を果たしていると考えられます。
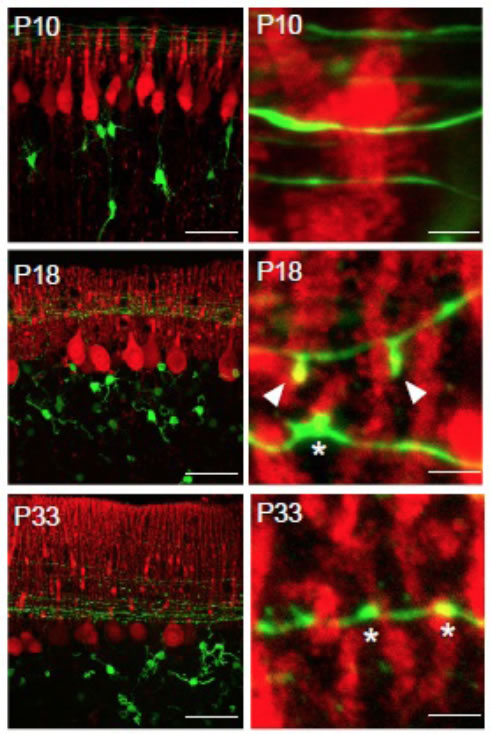
(図4説明)
小脳の発達過程における平行線維(GFP発現、緑)とプルキンエ細胞(calbindin染色、赤)の間に形成されるシナプス構造の変化。生後18日頃に特異的に、平行線維から微小な突起が形成されてプルキンエ細胞と接触する。
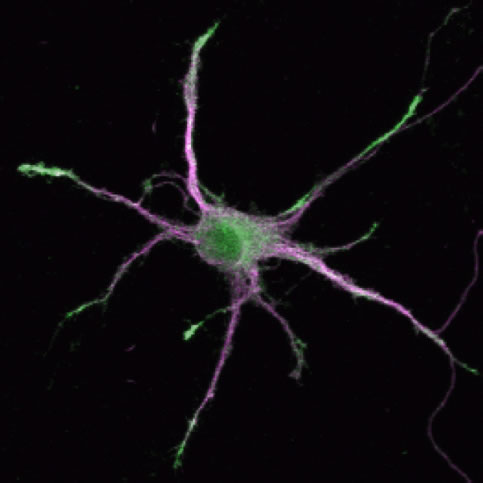
(図5説明)
DCLK蛋白質は樹状突起の先端に濃縮し、この部分での突起伸長を促進する。一方でDCLKにより樹状突起先端は軸索とシナプスを形成することから逃れ、動的な状態を維持する。緑:DCLK蛋白質、マジェンタ:樹状突起マーカーのMAP2の分布をそれぞれ示す。
Kawabata, I., Kashiwagi, Y., Obashi, K., Ohkura, M., Nakai, J., Wynshaw-Boris, A., Yanagawa, Y., and S. Okabe LIS1-dependent retrograde translocation of excitatory synapses in developing interneuron dendrites. Nature Communications 3, 722, 2012.
Ito-Ishida, A., Miyazaki, T., Miura, E., Matsuda, K., Watanabe, M., Yuzaki, M and S. Okabe Presynaptically released Cbln1 induces dynamic axonal structural changes by interacting with GluD2 during cerebellar synapse formation. Neuron 76, 549-564, 2012.
Shin, E., Kashiwagi, Y., Kuriu, T., Iwasaki, H., Tanaka, T., Koizumi, H., Gleeson, J. G. and S. Okabe Doublecortin-like kinase enhances dendritic remodeling and negatively regulates synapse maturation. Nature Communications 4, 1440, 2013.
Higashi T, Tanaka S, Iida T, and S. Okabe Synapse elimination triggered by BMP4 exocytosis and presynaptic BMP receptor activation. Cell Reports 22, 919-929, 2018.
IV. シナプスイメージングの疾患研究への応用
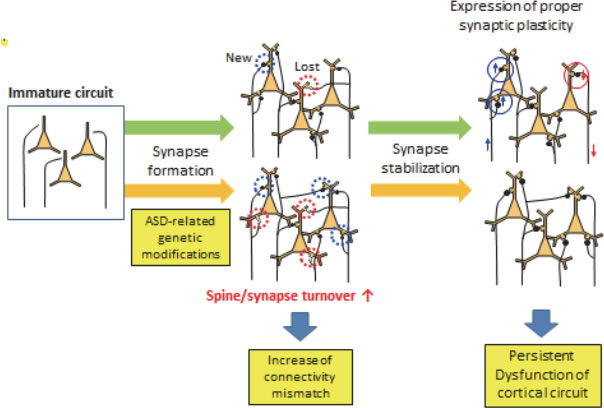
(図6説明)
自閉症モデルマウスで起こっている神経回路の変化。色々な遺伝的因子によりシナプスの形成と除去が過剰となり、それに伴って神経回路のつながりのミスが増加し、回路機能が低下する。
Isshiki, M., Tanaka, S., Kuriu, T., Tabuchi, K., Takumi, T. and S. Okabe Enhanced synapse remodelling as a common phenotype in mouse models of autism. Nature Communications 5, 4742, 2014.
V. 新しいシナプスイメージング技術
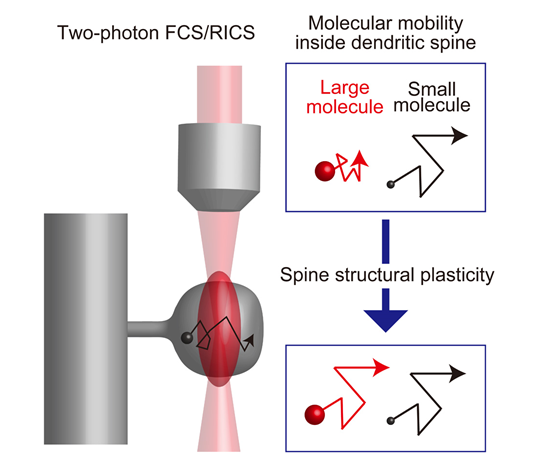
(図7説明)
蛍光相関測定によるスパイン内部の分子動態の推定。スパイン形態の可塑性誘導に伴い、大きな分子のみその拡散抑制が解除される。スパイン内部のシグナル分子の多くは分子量が100 kDa以上であり、これらの分子の結合や移動が短時間だけ促進されると予想される。
Kashiwagi, Y., Higashi, T., Obashi, K., Sato, Y., Komiyama, N., Grant, S. G. N. and S. Okabe Computational geometry analysis of dendritic spines by structured illumination microscopy. Nature Communications 10, 1285, 2019.
Obashi, K., Matsuda, A., Inoue, Y., and S. Okabe Precise temporal regulation of molecular diffusion within dendritic spines by actin polymers during structural plasticity. Cell Reports 27, 1503-1515, 2019.
VI. 将来展望
大脳皮質は高次認知機能を担う脳構造として哺乳類、特に霊長類で顕著に発達しています。大脳皮質の神経回路構築は哺乳類を通じて保存されており、円柱状の単位の中に興奮性と抑制性の神経細胞が配置されて皮質内に並列構造を形成しています。大脳皮質に存在する円柱状の単位構造と機能の関連が最も明確に示されているのは霊長類等の一次視覚野の眼優位性カラム、方位選択性カラムです。一方で大脳皮質の発生過程での興奮性細胞の垂線方向の移動パターンに一致してより小さなミニカラムと呼ばれる構造が形成されることも知られています。眼優位性カラムの様な機能と対応した大きなカラム構造とミニカラムの関係、ミニカラムを構成する興奮性細胞の投射パターン、ミニカラムでの興奮性・抑制性神経細胞の結合様式などはよくわかっていません。ミニカラムを大脳皮質の機能単位と想定することで、大脳皮質の回路の形成原理の一端が明らかになると期待されます。
培養細胞レベルでの実験でシナプス可塑性の誘導によりスパインの形態が特徴的な変化をすることは捉えられつつありますが、このようなスパイン微細形態の変化が個体レベルで記憶の形成や維持に伴って起こるのかは明らかではありません。活動依存的な遺伝子の発現を指標として用いることで、恐怖条件付けなどの学習パラダイムにおいて記憶の形成に関与する神経細胞(エングラム細胞)を同定・操作することが可能になりました。学習後にエングラムを構成する細胞の間に形成されるシナプスにおいて、スパインのナノ形態が培養細胞系で見られたのと同様の形態変化を起こすのか、またこの形態変化が記憶・学習に必要なのかを確認することは今後の重要な課題です。

